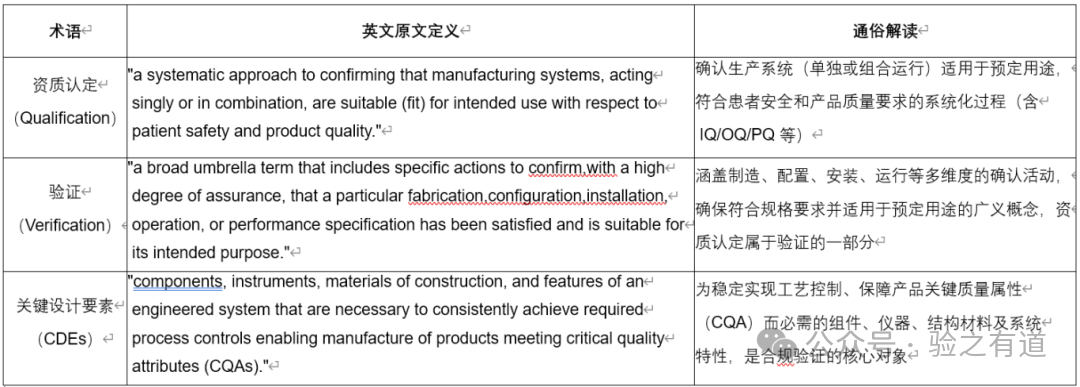
医药洁净室环境监测新国标(2025版)方法核心要点与理念变革总结
强制要求:三份标准均明确规定,在进行洁净室确认及监测时,应基于风险评估确定采样点的数目、位置(含水平和垂直)及监测频率。这标志着采样点不再是固定表格的简单套用,而是需要结合具体工艺、设施布局、人员活动、气流组织等潜在污染风险进行个性化设计
工具推荐:标准推荐使用故障模式效应分析(FMEA)、危害分析关键控制点(HACCP)等风险管理工具,使决策过程更加结构化、科学化。
明确区分了用于“分级/确认”的测试(静态/动态)和用于“常规监测”的动态测试。特别是GB/T 16292-2025新增了整个第7章“监测”,系统性地阐述了如何制定、执行、分析并持续改进监测计划,将环境监控视为一个动态的、不断优化的过程,而非一次性或周期性的静态检查。
悬浮粒子(GB/T 16292):对最少采样点数目表进行了精细化扩展(从面积≤2m²到>1000m²均有详细规定),并引入了基于面积大于1000m²时的计算公式(NL=27×A/1000)。删除了固定采样次数的要求,更关注单点采样量的充足性(确保能检测到至少20个粒子)。
沉降菌(GB/T 16294)与浮游菌(GB/T 16293)最少采样点:两者均提供了基于面积的最少采样点数目表格,并统一了对于面积>1000m²的计算逻辑。沉降菌最少采样点数为“浮游菌最少采样点数基础上增加3个”(NL=27×A/1000 + 3),以增加空间覆盖率;浮游菌则简化为悬浮粒子分级测试最少采样点数除以3(NL=27×A/1000 / 3),体现了风险平衡
删除了“最少培养皿数”和“结果评定”:将具体的合格判定权交还给使用单位基于其产品工艺和风险接受标准,标准更专注于提供科学可靠的检测方法。
暴露/采样时间:
沉降菌测试强调暴露时间一般不大于4小时,需评估特定环境下培养基的耐受性。
浮游菌测试明确规定了不同洁净级别(如ISO 5/A级、ISO 7/B级等)所需的最小采样量(如500L、100L),更具指导性。
培养方案:
统一并细化了培养条件。对于普通TSA培养基,推荐采用两阶段温度培养法(如20-25℃培养3-5天后再转至30-35℃培养2-3天,或反之),以更全面地捕获环境中可能存在的细菌和真菌。当使用沙氏培养基(SDA)时,规定在20-25℃培养5-7天。
统一引用GB/T 25915.1的术语,如“静态”、“动态”的定义,增强了与ISO标准的协调性。
悬浮粒子标准详细描述了光散射粒子计数器的工作原理与校准要求(需符合GB/T 29024.4)。
微生物测试标准明确要求培养基需符合《中华人民共和国药典》2025年版四部的相关规定,确保了基础材料的质量。
企业需要具备进行科学风险评估的能力,并基于评估结果制定个性化的、动态的环境监测方案,这对人员的专业知识和质量风险管理水平是巨大考验。
需要建立完整的风险评估报告、监测计划制定与审批记录、数据趋势分析报告以及基于数据的计划持续改进记录。
品质铸生命,创新引未来 苏州雷赛环境科技有限公司,捍卫每一支药品的无菌保障。
立即获取专属解决方案
📞 咨询热线:张经理:18112520723(微信同号) 伍经理:15161988892(微信同号)